|
Unterrichtsmaterialien - Chr. Blaschke - Albrecht-Dürer-Schule Weiterstadt
Zu den Aufträgen 6 bis 8: Die Regeln zur Benennung von Alkanen möchte ich Euch in ein oder mehreren Teams-Konferenzen erklären! Achtung: Hier die Unterrichtsmaterialien für die ersten beide Aufträge als pdf-Dokument Ihr müsst nicht alle Materialien ausdfrucken, ihr könnt die Lösungen direkt in Word eingeben oder aufschreiben und fotographieren! Viel Spaß! Organische Stoffe
sind Kohlenstoffverbindungen. Die Organische Chemie ist die Chemie der
Kohlenstoffverbindungen. Dementsprechend enthalten alle organische Stoffe
enthalten Kohlenstoffatome (Elementsymbol C).
Holz, Bienenwachs, Medikamente, Farbstoffe und Kunststoffe
sind Beispiel für organische Stoffe. Bemerkenswert
ist, dass in Kohlenstoffverbindungen nur sehr wenige weitere Elemente
vorkommen, vor allem Wasserstoff, Sauerstoff und Stickstoff. Daneben können auch
Schwefel, Phosphor und Halogene enthalten sein.
Doch diese wenige Elemente bilden eine schier unglaubliche Fülle an Verbindungen:
Im Jahre 2012 waren etwa 40 Millionen organische Verbindungen bekannt!
Von anorganische Verbindungen (Verbindungen, die also keine Kohlenstoffatome enthalten!) sind bislang nur rund 100 000 bekannt. Einige Verbindungen werden trotz Kohlenstoffatom(en) zur Anorganischen Chemie gerechnet: Kohlenmonoxid, Kohlendioxid sowie die Kohlensäure und ihre Salze.
Alkane (= Kohlenwasserstoffe) sind Verbindungen, deren Moleküle nur aus Kohlenstoff-Atomen (C-Atomen) und Wasserstoff-Atomen (H-Atomen) aufgebaut sind.
Die Bedeutung der Alkane für die Menschen ist recht groß;
schließlich bestehen alle fossilen Energieträger wie Kohle, Erdöl und Erdgas
aus einem Gemisch verschiedener Alkane. Neben dieser Funktion als
Energielieferant sind Alkane wichtige Ausgangsstoffe für chemische Synthesen.
Vereinfacht gesprochen: Aus Alkanen kann man fast alles herstellen: Kunststoffe,
Medikamente, Farben und so weiter.
Die homologe Reihe der Alkane
Schauen Sie sich beide Videos an:
Auftrag 1: Ergänzen Sie folgende Tabelle:
2.1 Wie lautet die allgemeine Summenformel
für Alkane. Ergänze:
Alkane
kommen in der Natur hauptsächlich in Kohlelagerstätten, Erdöl und Erdgas vor. Es sind reaktionsträge Verbindungen.
3 Arbeitsaufträge:
3.1 In welcher Hauptgruppe steht das Element Kohlenstoff? Wie viele Außenelektronen besitzt es? 3.2 Wie viele Bindungspartner kann ein Kohlenstoffatom maximallen haben? Begründen Sie!
Bauprinzip von
Ethan:
Verzweigte Alkane und Isomerie
Ab vier C-Atomen
kann ein Alkan nicht nur eine Kette bilden, sondern auch verzweigt vorliegen.
Deswegen kommen alle Alkane mit einer höheren Zahl an Kohlenstoffatomen als
Propan in einer Vielzahl von Isomeren -
Molekülen mit der gleichen Summenformel, aber unterschiedlichem Aufbau vor.
Beispiel: Strukturisomere des Butans C4H10
(Quelle: http://www.tgs-chemie.de/alkane.htm)
4 Aufträge: 4.1 Zeichnen Sie alle
Strukturisomere des Pentans C5H12.
4.2 Zeichnen Sie die Strukturformel des Alkans mit folgender Summenformel: C6H12. Hilfe?
Um die enorme Vielfalt der
organischen Verbindungen zu benennen (siehe Tabelle), hat man erstmals 1892 auf
einem internationalen Kongress in Genf systematische Nomenklaturregeln
festgelegt. Aus diesem Kongress heraus entwickelte sich eine Organisation, die
unter dem Namen „International Union of Pure and Applied Chemistry“ (= IUPAC) bekannt ist. Sie bringt die
Nomenklaturregeln ständig auf den neuesten Stand.
Nomenklatur von Alkanen
Vorgehen
(2) Seitenketten (Alkylreste, z.B. Methyl -, Ethyl - etc.) benennen und alphabetisch ordnen (3) Die Anzahl der gleichen Seitenketten (Reste) feststellen und mit dem entsprechenden (4) Verbindungsstellen zwischen Hauptkette und Resten ermitteln, C-Atome der Hauptkette so durchnummerieren, dass die Seitenketten an kleinstmöglichen Zahlen "sitzen".
Beispiel:
6.1 6.2
6.3
6.4 6.5 6.6 Auftrag 7: Gib die Strukturformeln der folgenden Verbindungen an
Auftrag 8:
Physikalische Eigenschaften der Alkane: Schmelz- und Siedetemperaturen, LösungsverhaltenAchtung: Hier die Unterrichtsmaterialien für die Aufträge 9 bis 12 als Word-Dokument I als pdf-Dokument Achtung: Hier ein Quiz zum Üben! Viel Spaß! Schmelz- und Siedetemperaturen der Alkane:
Auftrag 9: 9.1 Mit was ändern sich die Eigenschaften? Mit der Ke........ 9.2 Je länger die Kette .... 9.3 Welche Kräfte herrschen zwischen den Teilchen? Hilfesvideo: 9.4 Ab welchem Alkan sind sie flüssig, ab wann fest? 9.5 Die Siedetemperatur ist um so höher, je .... 9.6 Je unverzweigter, desto ........................... die Siedetemperatur. Jenäher die Teilchen zusammenliegen ......................... . 9.7 Warum lagern sich Alkane auf Wasser ab? 9.8 Die Dichte der Alkane steigt mit ........... 9.9 Was bedeutet unpolar? 9.10 Was bedeutet genau "Gleiches löst sich in gleichem"? Auftrag 10:
10.1 Begründen Sie den Anstieg der Schmelz- und Siedetemperaturen. Verwenden und definieren Sie dabei folgende Begriffe: Unpolar, Van-der-Waals-Kräfte, zwischenmolekulare Kräfte, Molekülmasse bzw. Kettenlänge. 10.2 Die Schmelz- und Siedepunkte der verzweigten Alkane liegen im allgemeinen unter denen der entsprechenden unverzweigten Alkane (= n-Alkane). Finden Sie eine Erklärung! Löseverhalten der Alkane
Auftrag 11:
Auftrag 12: Wiederholungsaufgaben (1) Benennen Sie folgende Kohlenwasserstoffverbindung: Auftrag 13: Benennung von Alkanen - ein Domino Versuch:
Achtung: Dies wird nicht im Video gezeigt. Das Verhältnis zwischen Benzindämpfen und Sauerstoff muss stimmen! Gibt man zuviel Benzin hinzu, so ist das Gemisch "zu fett", und es findet keine Explosion statt! Dazu auch folgenden Video: Auftrag 14: Ergänze mit Hilfe des Videos oben die Tabelle:
Auftrag 15: Informiere Dich hier über die Zündgrenzen eines (a) Benzin/Luft-Gemisch und (b) eines Diesel-Gemisches Auswertung:
Benzin oder Diesel? Nicht selten füllt man den falschen Treibstoff in den Tank, und dann gibt es Probleme, denn jeder Motortyp braucht einen besonderen Kraftstoff. Benzin. Otto-Motoren benötigen Benzin. Darunter versteht man ein Gemisch aus Alkanen mit fünf bis zwölf Kohlenstoff-Atomen im Molekül. Doch Benzin wird erst durch bestimmte Zusätze zu einem Kraftstoff. Dabei entscheiden Art und Menge der Zusätze, ob Normalbenzin oder Superbenzin entsteht. Normalbenzin und Superbenzin unterscheiden sich hauptsächlich in ihrer Klopffestigkeit. Ein Motor "klopft", wenn sich ,das Benzin/Luft-Gemisch in der Verdichtungsphase von selbst entzündet, bevor der Zündfunke ausgelöst wird. Durch diese Frühzündung erhält der Kolben in der Aufwärtsbewegung einen Schlag, der ein klopfendes Geräusch erzeugt. Als Maß für die Klopffestigkeit eines Kraftstoffs gilt die Oktanzahl: Reines' Isooctan (2,2,4-Trimethylpentan) besitzt eine hohe Klopffestigkeit. Ihm ordnet man die Oktanzahl 100 zu. Reines n-Heptan lässt den Motor dagegen besonders leicht klopfen. Es erhält die Oktanzahl O. Normalbenzin hat in der Regel die Oktanzahl 92, das heißt, es verhält sich hinsichtlich seiner Klopffestigkeit wie ein Gemisch aus 92 % Isooctan und 8 % n-Heptan. Die Oktanzahl von Superbenzin liegt bei 95. Die höhere Klopffestigkeit ist erforderlich, da das Kraftstoff/Luft-Gemisch in Superbenzin-Motoren stärker verdichtet wird. Solche Motoren erzeugen also einen höheren Druck und sind deshalb empfindlicher für Frühzündungen. Antiklopfmittel. Die erforderlichen Mengen klopffesten Benzins lassen sich nur gewinnen, wenn man Antiklopfmittel verwendet. Jahrzehnte lang wurde dem Benzin daher Bleitetraethyl (Pb(C2H5)4) beigemischt. Die im Abgas enthaltenen Blei-Verbindungen belasteten jedoch die Umwelt und schädigen die Abgaskatalysatoren. Heute setzt man daher überwiegend Methyl-tert-butylether (MTBE) ein: Ein Zusatz von etwa 10 % garantiert die geforderte Klopffestigkeit. Umweltschützer weisen aber darauf hin, dass Methyl-tert-butylether heute schon in manchen Gewässern nachweisbar ist Diesel-Öl. Diesel-Motoren verdichten das Kraftstoff/Luft-Gemisch besonders stark. Dadurch steigt die Temperatur des Kraftstoff/Luft-Gemischs so stark an, dass es sich selbst entzündet. Bei diesen Bedingungen eignet sich Diesel-Öl als Kraftstoff, ein Gemisch aus Alkanen mit zehn bis zwanzig Kohlenstoff-Atomen im Molekül. Aber auch dieser Kraftstoff kommt nicht ohne Zusätze aus. So verhindert ein Additiv, dass an kalten Tagen ein Teil als Paraffin ausflockt und die Kraftstoffzufuhr behindert. Bio-Kraftstoffe. An immer mehr Tankstellen gibt es Bio- Diesel, einen Kraftstoff, der aus Rapsöl gewonnen wird; er stammt damit aus nachwachsenden Rohstoffen. Jährlich werden in Deutschland etwa 45000 t Bio-Diesel verbraucht. In Südamerika wird in großem Maße Bio-Alkohol aus der Vergärung von Zucker als Kraftstoff verwendet. Auftrag 16: Beantworte mit Hilfe des Textes folgende Fragen: 1 a) Informiere dich über Bau und Arbeitsweise eines Viertakt-Motors und eines Diesel-Motors. b) Was versteht man unter einer Frühzündung? 2 a) Was versteht man unter Bio-Kraftstoffen? 3 Zeichne die Strukturformel von 2,2,4-Trimethylpentan. Warum nennt man diesen Stoff Isooctan? 4 In Brasilien wird Bio-Alkohol getankt. Welche Vorteile und welche Probleme sind damit verbunden? Auftrag 17: Bewusst Autofahren - Energie sparen: Erdölverarbeitung: CrackenEtwa 35% des Erdöls wird für Benzin benötigt. Im Durchschnitt liegt der Benzinanteil der Öle jedoch nur bei 15-20%! Katalytisches CrackenIm Erhitzer werden die zu spaltenden Kohlenwasserstoffe vorgeheizt und danach mit dem aus dem Regenerator kommenden 650°C heißen Katalysator, einem Gemisch aus Al2O3 (Aluminiumoxid) und SiO2 (Siliciumdioxid), versetzt. Dabei verdampft das Gemisch vollständig und gelangt in den Reaktor. Bei den vorherrschenden hohen Temperaturen geraten die langen Kohlenstoffmoleküle in starke Schlingerbewegungen, so dass sie auseinanderreißen. Durch das Cracken lässt sich zum Beispiel aus Paraffinöl oder aus Kerzenwachs Benzin herstellen. Bei dem folgenden Beispiel zerbricht Decan in zwei kleinere Moleküle.
Auftrag 17: (1) Warum ist das "Cracken" notwendig? (2) Beschreibe anhand des Beispiel von Decan den Crackvorgang!
Alkene, Alkine (ungesättigte Kohlenwasserstoffe)Versuch: Calciumcarbid--Böller Versuch: Beobachtung: Auftrag 19: Beschreiben Sie in eigenen Worten den Versuch! Auftrag 20: Wo wird heute noch das Carbidschießen vorgeführt und woher hat es seine Wurzeln? Und die Scheiben gehen kaputt: Auswertung: CaC2 (s) + 2 H2O Der unangenehme Geruch des Phosphins geht auch von den verunreinigten Brocken aus, da diese bereist mit der Luftfeuchtigkeit reagieren.
Alkene und AlkineAchtung: Hier die Unterrichtsmaterialien für die Aufträge 21 bis 29 als Word-Dokument I als pdf-Dokument Alkene enthalten mindestens eine C-C-Doppelbindung. Der Name entspricht dem des Alkans, nur wird statt der Endung "an" die Endung "en" angehängt. Die Stellung der Doppelbindung (möglichst kleine Ziffer) wird als Ziffer an den Namen angehängt. Alkine enthalten mindestens eine C-C-Dreifachbindung. Entsprechend wird statt der Endung "an" die Endung "in" angehängt. Auftrag 21: Ergänze die Tabelle - Hilfe
Auftrag 22 - Lesen Sie den unteren Text und beantworten Sie folgende Frage: Wie bezeichnet man Doppelbindungen und die Elektronen einer Doppelbindung? Vereinfachtes Bindungsmodell („Bananenbindung“)Ethen:
Auftrag 22: Mit Hilfe dieser App können Sie sich das das Ethanmolekül, das Ethenmolekül und das Ethinmolekül dreidimensional betrachten bzw. drehen. Betrachten Sie die Moleküle und fertigen Sie jeweils eine Skizze an!
Auftrag 24: Teste Dich online! E/Z-Isomerie (früher cis/trans-Isomerie)Arbeitsauftrag:
(nur die erste Minute!)
Auftrag 25: Welches Isomer ist energieärmer? Und warum? Denke daran, dass sich Atome abstoßen! Wo sind die Methylgruppen also energetisch günstiger angeordnet?Auftrag 26: Zeichne E (trans)-1,2-Dichlorethan und Z(cis)-1,2-Dichlorethan. Wirklich schwer, hier findest DuHilfe Regeln der Nomenklatur von Alkenen und Alkinen1. Zunächst muss die längste Kohlenstoffkette mit den meisten Doppel- bzw. Dreifachbindungen gesucht werden. Diese Hauptkette bestimmt den Stammnamen des Alkens. Die Hauptkette ist so zu nummerieren, dass die Summe der Positionen der Mehrfachbindungen möglichst klein ist. 2. Je nach Anzahl an Mehrfachbindungen geben sich Endungen wie: -en, -adien, -in, -enin, -adienin etc. Vor dem Stammnamen werden die Positionen der Mehrfachbindungen angegeben. Kommen in einem Molekül Zweifachbindungen und Dreifachbindungen vor, stehen die Nummern der Dreifachbindungen zwischen dem Alkanstammnamen und der Endung –in. Beispiel oben: 3. Substituenten werden in alphabetischer Reihenfolge, mit den entsprechenden Vorsilben (di-, tri-, tetra) versehen und mit Nummern für die Positionen dem Stammnamen vorangestellt. Substituenten ohne Doppelbindung werden als Alkyl-Reste bezeichnet. Bei Doppelbindungen in den Seitenketten spricht man von Alkenyl (entsprechend bei zwei Doppelbindungen Alkadienyl- etc.). Bei Dreifachbindungen spricht man von Alkinyl-Resten. Substituenten mit verzweigten Seitenketten oder mit funktionellen Gruppen werden in Klammern geschrieben (innerhalb einer solchen Seitenkette wird von der Verknüpfungskette zur Hauptkette aus gezählt). Beispiel oben: Auftrag 27: Aufgabe 28:
Beispiele für ungesättigte Kohlenwasserstoffe
Aufgabe 29: Wozu wird Ethin verwendet? Und wozu Butadien?Nach den Osterferien -Teams Aufgabe 6Achtung: Hier die Unterrichtsmaterialien für die Aufträge 30 bis 36 als pdf-Dokument Aufgabe 30 - Wiederholungsaufgaben 30.1 Stellen Sie eine Reaktionsgleichung für die vollständige Verbrennung von Ethan auf. 30.2 Benennen Sie
30.3 Zeichnen Sie die Strukturformeln von a) 2,4-Dimethyl-hexan b) 3,3-Diethyl-2-methylheptan c) 1,3-Oktadien Die radikalische SubstitutionVersuch – Zugabe von Brom zu HexanDurchführung:
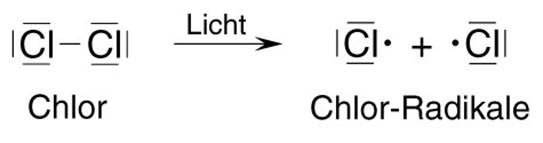
Auftrag 31: Schaue Dir das Video oben bis zur Minute 2:03 an. Notiere die Beobachtungen! Hier noch einmal die Durchführung in Kurzform Was passiert mit dem angefeuchteten Indikatorpapier? Auswertung:
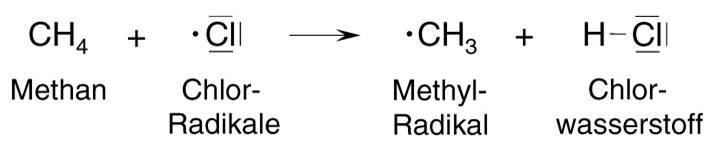
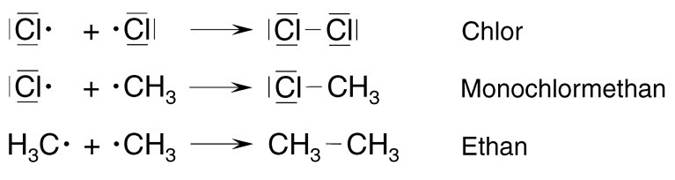
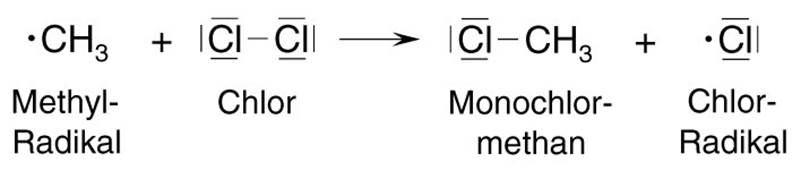
Auftrag 32: Schaue Dir nun das Video oben ab Minute 2:03 an. Notiere Dir die Realtionsgleichungen für die drei Reaktionsschritte in Form von Strukturformeln und erkläre! Hilfe Hier bekommst Du auch noch einmal alles erklärt Auftrag 33 : Versuchen Sie, die einzelnen Schritte der Reaktion unten in die richtige Reihenfolge zu bringen! Begründen Sie!
Auftrag 34 - Geben Sie für die Darstellung im Kugel-Teilchen-Modell die entsprechenden Reaktionsgleichungen an:
Auftrag 35 - Formulieren Sie den Reaktionsmechanismus für die Darstellung von Mono-Chlorethan. Benennen Sie die einzelnen Reaktionsschritte und erklären Sie! Auftrag 36: Wofür werden Halogenalkane verwendet? Recherchieren Sie - https://www.w-hoelzel.de/component/tags/tag/radikalische-substitution Ab 6. Mai 2021 Induktive Effekte, etc (Download als Word-Dokument) |
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||